![]()
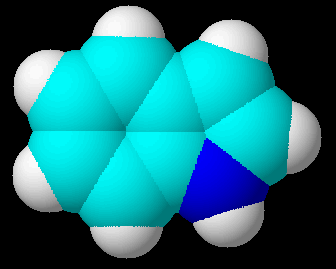 |
|
| Möchten Sie diese 3D-Struktur von allen Seiten betrachten? Dann laden Sie sich doch einfach ChemSketch von ACDLabs herunter und klicken dann auf die Struktur. Mit ChemSketch können Sie zukünftig Ihre eigenen 3D-Formelbilder entwerfen. | Strukturformel (erstellt mit ChemWeb) |
| Andere Namen: | 1H-Benzo-[b]pyrrol; engl. indole,
2,3-Benzopyrrole; frz. indol, indole; ital. indolo Der Name Indol stammt von den Begriffen Indigo und Oleum (A. von Baeyer 1869) |
| BRN1: | 107693 |
| CAS2-No.: | [120-72-9] |
| EG-/EINECS3-No.: | 204-420-7 |
| Arctander: | 1772 |
| Fenaroli: | 371 |
| FEMA4-No.: | 2593 |
1 = Beilstein Registry
Number
2 = Chemical Abstracts Service
registry number
3 = European INventory of Existing
Chemical Substances number
4 = Flavor and Extract Manufacturers´
Association of the United States number
Vorkommen:
In der Natur kommt Indol als Bestandteil zahlreicher ätherischer Öle vor; hervorzuheben ist das Vorhandensein im Jasminblütenöl mit einem Anteil von immerhin 2,5% (A. Hesse/F.Müller). Nennenswert sind auch die Gehalte im Orangenblütenöl (= Neroliöl) mit 0,1%, ferner im Goldlackblüten- und Akazienblütenöl (gemeint ist hier die sog. "falsche" Akazie, Robinia pseudoacacia) sowie im Aronstab. Daneben wird Indol im Steinkohlenteer aufgefunden, und zwar ist es in den zwischen 240 und 260 °C siedenden Fraktionen enthalten (0,2%). Durch Erhitzen der Teerfraktion mit Ätzkali läßt sich das Indol in Form seiner N-Kaliumverbindung erhalten.
Zusammen mit dem ebenfalls durchdringend und unangenehm riechenden Skatol (Methylindol) ist Indol als Abbauprodukt der Aminosäure Tryptophan (b-Indolyl-alanin) in den Fäkalien von Mensch und Tier enthalten. Zibet, ein Sekret aus den Drüsen der Zibetkatze, enthält ebenfalls Indol.
Beschreibung:
Der Riechstoff tritt in Form farbloser Blättchen oder Kristallschuppen in Erscheinung; bei der Lagerung (insbesondere bei Licht- bzw. Luftzutritt) verfärbt er sich meist rötlich oder bräunlich. Indol ist in den üblichen organischen Lösungsmitteln wie Ethanol, Methanol, Diethylether, Chloroform und Benzol leicht löslich, während er in Wasser nur begrenzt löslich ist. Heißes Wasser löst den Stoff nicht unerhebluchIn reinster oder in hochverdünnter Form riecht die Substanz blumig-blütenhaft, während sie in unreinerem Zustand einen beißend-unangenehmen, fäkalischen Geruch verströmt.
Indol weist schwach basische Eigenschaften auf. Mit Säuren werden allerdings keine Salze gebildet, sondern es erfolgt (insbesondere bei Erwärmung) eine Polymerisation zu harzartigen Produkten.
Gewinnung:
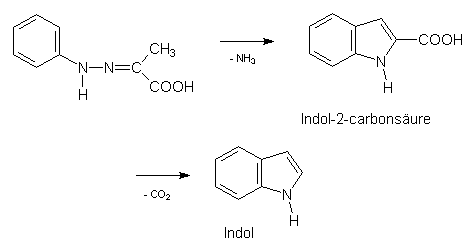
Indol kann aus dem Steinkohlenteer isoliert werden. Daneben sind für Indol und Indolabkömmlinge einige Synthesemöglichkeiten erarbeitet worden. Die wohl bekannteste stammt von dem berühmten Chemiker E. Fischer, welcher von Phenylhydrazonen ausging. Verwendet man das Phenylhydrazon der Brenztraubensäure, so bildet sich (unter Abspaltung von Ammoniak) die Indol-3-carbonsäure, welche nach Decarboxylierung Indol liefert:
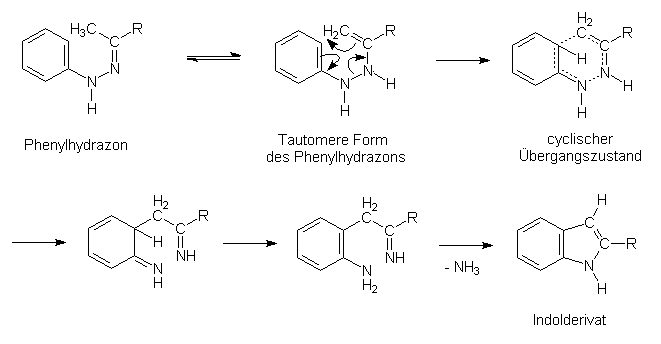
Als Katalysatoren lassen sich Säuren oder Metallhalogenide (v.a. Zinkchlorid) einsetzen. Der Mechanismus wurde von den Forschern R. und G.M. ROBINSON mit einem cyclischen Übergangszustand wie folgt formuliert:
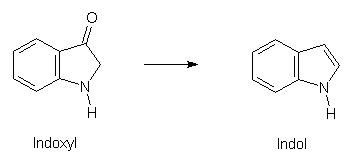
Eine andere Methode der Darstellung geht vom Indoxyl aus, welches bei der technischen Synthese von Indigo anfällt. Diese Verbindung wird mit Natriumamalgam (oder mit Hilfe von Zinkstaub/Alkali) zu Indol reduziert:
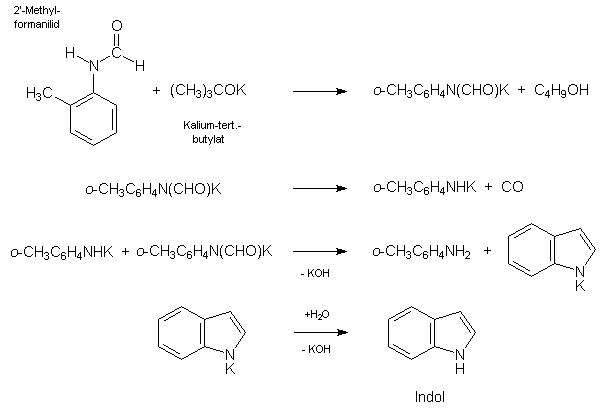
Interessant ist auch die sog. MADELUNG-Synthese nach dem Verfahren von TYSON, die vom 2'-Methyl-formanilid (Formel siehe Schema unten, bitte nicht verwechseln mit N-Methylformanilid!) ausgeht, welches mit Kalium-tert.-butylat als Kondensationsmittel umgesetzt wird. Dieses Agens wird unmittelbar vor der Umsetzung aus tert.-Butanol und metallischem Kalium unter Stickstoffatmosphäre hergestellt. Die Reaktion findet bei einer Temperatur zwischen 350 und 360 °C ebenfalls in Stickstoffatmosphäre statt (Vorschrift in: Org.Synth., Coll.Vol.III, p. 479).
Die Ausbeute an Indol mit Schmelzpunkt 52-53 °C betrug nach Aufarbeitung durch Destillation 79%.
Das benötigte 2'-Methyl-formanilid oder N-Formyl-o-toluidin, ein Ameisensäureamid, kann seinerseits durch Einwirkung von Ameisensäure auf o-Toluidin (2-Methyl-anilin) nach der ebenfalls im Artikel von TYSON beschriebenen Methode hergestellt werden. Diese Umsetzung erfolgt bei Verwendung von 99%iger Ameisensäure nahezu quantitativ.
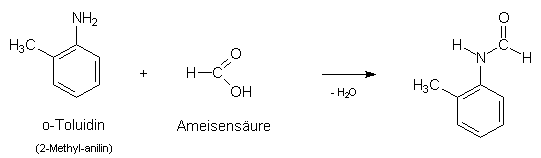
Chemische und physikalische Kennzahlen der Reinsubstanz:
| Molekülmasse: 117,15 g/mol | 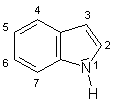 |
| Summenformel: C8H7N |
| Parameter | Wert (z.B. H=Hunnius, RK=Roth/Kormann, R=Römpp, M=Merck) | Bereich (FCC 3) | |
| Schmelzpunkt | m.p. | 51-54 °C (Aldrich); 52 °C (Poucher, R), 52,5 °C (CRC, H) | NLT 51 °C (dried over sulfuric acid) |
| Siedepunkt | b.p. | 253 °C (Poucher, R); 253-254 °C (H); 254 °C (CRC) | --- |
| Dichte 25 °C | s.g./density | 1,22 (CRC, R) | --- |
| Brechungsindex 20° | refr. index | --- | --- |
| Löslichkeit in Ethanol | solubility (alcohol) | leicht löslich | 1 g in 3 ml 70% alc. |
| Löslichkeit in Wasser | solubility (water) | begrenzt löslich | soluble |
Hinweise zur Entsorgung
Es liegen keine einheitlichen Bestimmung zur Entsorgung von Chemikalien bzw. Reststoffen in der EG vor. Chemikalien, die als Reststoffe anfallen, sind in der Regel Sonderabfälle. Deren Beseitigung ist durch entsprechende Gesetze bzw. Verordnungen der EG-Mitgliedsländer sowie in der Bundesrepublik Deutschland auch durch die einzelnen Bundesländer geregelt. Bitte nehmen Sie mit der zuständigen Stelle (Behörde, z.B. Landratsamt, oder Abfallbeseitigungsunternehmen) Kontakt auf, die über die Entsorgung informieren.
Deutsche Vorschriften
Flammpunkt: 121 °C
MAK-Wert: keine Angabe
![]()
Die im vorliegenden Chemikalien-Lexikon enthaltenen Informationen dienen zu wissenschaftlichen Schulungszwecken. Sie sind nicht dazu bestimmt, irgendwelche Eigenschaften von Produkten oder deren Eignung für einen bestimmten Verwendungszweck zuzusichern. Die Benutzung der Informationen geschieht auf vollkommen eigene Verantwortung des Lesers. Jegliche Haftung für Schäden, Folgeschäden oder Verluste, die beim Umgang mit den hierin beschriebenen Stoffen oder Zubereitungen oder bei der Durchführung der im Lexikon enthaltenen chemischen Versuchsbeschreibungen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Mit dem Abrufen und Benutzen der Daten erkennt der Benutzer diese Bedingungen an.
Es wird ausdrücklich darauf hingewiesen, daß für den Umgang mit Gefahrstoffen zahlreiche gesetzliche Regelungen und Einschränkungen gelten. Chemikalien dürfen nur von Personen mit der erforderlichen theoretischen und praktischen Sachkenntnis unter Einhaltung aller national gültigen Vorschriften gelagert und verwendet werden. Die dem jeweiligen Stand der chemischen Wissenschaft und Technik entsprechenden Sicherheitsvorkehrungen, Unfallverhütungsrichtlinien und Maßnahmen zur Arbeitshygiene sind ebenfalls einzuhalten.
Erstellt am 12.03.2001 * Letzte Änderung am 19.03.2001